Selbstzerstörungs-Mechanismus in Pilzsporen schützt uns vor Infektion
Pilzsporen fliegen ständig und überall durch die Luft und wir atmen täglich tausende, wenn nicht mehr, davon ein. Unter diese Sporen mischt sich auch der berüchtigte Aspergillus fumigatus – ein Pilz, der Krankenhausinfektionen* (invasive Aspergillose) mit einer Sterblichkeitsrate von bis zu 40-90% zu verantworten hat. Warum aber werden gesunde Menschen nicht krank? Wissenschaftler aus den USA, Deutschland und Israel haben jetzt herausgefunden, dass unsere Immunabwehr in von uns eingeatmeten Pilzsporen einen Selbstzerstörungsmechanismus auslöst – und sie damit zum Selbstmord zwingt (Science).
Von anderen Pilzen war bereits bekannt, dass sie Proteine bilden, die sie vor dem selbst-ausgelösten Zelltod schützt – sogenannte Schutzproteine. „Wir wollten wissen, ob die auch [bei Menschen] wichtig sind. Wir hatten keine Ahnung, […] dass unsere menschlichen Neutrophilen einfach den Selbstmordschalter des Pilzes drücken müssen“, erklärt Mitautor Prof. Gerhard Braus von der Universität Göttingen. Neutrophile gehören zu den weißen Blutkörperchen und dienen der Immunabwehr des Menschen.
Zunächst haben die Wissenschaftler mittels Fluoreszenzfarbstoffen herausgefunden, dass in den Pilzsporen Anzeichen für den programmierten Zelltod auftreten, wenn diese in die Lunge von Mäusen gelangen. Dazu gehörten die Aktivität eines bestimmten Enzymes, die Fragmentierung der DNA und schließlich der Zelltod. Auch A. fumigatus besitzt zwar ein Schutzprotein (BIR1 genannt), das unter normalen Bedingungen dafür sorgt, dass das Programm des Zellselbstmords nicht aktiviert wird, allerdings kann die gesunde Maus dieses Protein umgehen: die Immunzellen senden ein Signal (Wasserstoffperoxid; H2O2) aus, das wiederum den programmierten Zelltod in der Spore auslöst.
Die Autoren haben dann untersucht wie die Pilzsporen mit erhöhten Mengen des Proteins auskommen und vor allem wie das Immunsystem der Maus darauf reagiert. Ausgerüstet mit mehr Schutzprotein überlebten die Sporen besser unter bestimmten Stressbedingungen (in vitro – also im Reagenzglas) und plötzlich widerstanden sie auch den Angriffen des Immunsystems einer gesunden Maus. Mäuse, die diese Sporen einatmeten, entwickelten häufiger eine invasive Aspergillose (also eine Infektion der Lunge) als Mäuse, die den normalen Kontrollstamm einatmeten. Diese Art der Infektion tritt sonst nur in geschwächten Mäusen (oder Menschen) auf.
„Im Prinzip haben wir kein Mittel gegen den Pilz – und wenn der Trick mit dem Selbstmordknopf nicht funktioniert, dann hat die Maus – und wohl auch wir – Schwierigkeiten“, kommentiert Prof. Braus diese Entdeckung. Die Sporen können sich mit der erhöhten Menge Schutzprotein viel besser schützen (ähnlich agieren im Übrigen auch Krebszellen) oder anders gesagt: die Immunzellen der Maus sind nicht mehr in der Lage den Selbstmord auszulösen.
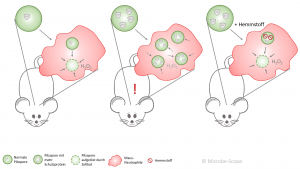
Unter normalen Bedingungen kann die Maus-Neutrophile die Pilzspore aufnehmen und das Schutzprotein umgehen – die Spore wird zur Selbstzerstörung gezwungen. Produziert aber die Spore mehr des Proteins, kann die Neutrophile die Sporen nicht bekämpfen und nimmt immer mehr davon auf. Schließlich keimen die Sporen aus und befällt die Lunge. Die Maus erkrankt. Wird das vermehrte Schutzprotein wiederum gehemmt, bewältigt auch die Neutrophile ihre Aufgabe wieder und die Maus bleibt gesund.
Schließlich setzten die Wissenschaftler noch einen bekannten Hemmstoff des Schutzproteins ein, um aufzuzeigen, dass die vermehrten Infektionen tatsächlich mit diesem Protein zusammenhängen. Sie ließen die Mäuse auch diesen Stoff einatmen und stellten fest, dass mit der Hemmung des Schutzschildes sich die Mäuse wieder erfolgreich gegen die Sporen wehren konnten und diese mit Hilfe des Signals in die Selbstzerstörung schickten. Dieses Signal kann auch von unseren Immunzellen ausgesandt werden und damit ist es sehr wahrscheinlich, dass sie den gleichen Mechanismus verwenden, um die Pilzsporen zu beseitigen – durch die Aktivierung des Selbstzerstörungsmechanismus.
Menschliche Zellen besitzen ebenfalls einen Mechanismus für den programmierten Zelltod, allerdings unterscheidet sich das System grundlegend von dem in Pilzen. Aus diesem Grund messen die Autoren ihrer Entdeckung eine besondere Bedeutung zu. Die Tatsache, dass die Menge dieses einen Proteins über Krankheit oder Gesundheit entscheiden kann, lässt sich möglicherweise für die Behandlung von betroffenen Patienten einsetzen. Denn auch wenn in immungeschwächten Patienten sicherlich mehrere Faktoren bei der Entwicklung der Aspergillose eine Rolle spielen, so konnte doch in der Studie gezeigt werden, dass das Immunsystem der Maus mit Hilfe des Hemmstoffes bei der Bekämpfung der Sporen unterstützt wurde. Und das ist möglicherweise ein entscheidender Schritt in der Therapie der invasiven Pilzinfektionen beim Menschen.
* Als Krankenhausinfektion bezeichnet man Krankheiten, die sich Patienten meist während ihres Krankenhausaufenthaltes durch ihr bereits geschwächtes Immunsystem zusätzlich zuziehen
Siehe auch:
Quellen:
Shlezinger et. al., 2017. Sterilizing immunity in the lung relies on targeting fungal apoptosis-like programmed cell death. Science
Titel Foto: Case courtesy of A.Prof Frank Gaillard, Radiopaedia.org. From the case rID: 8690